顶刊《新英格兰医学杂志》最新发布人类首款mRNA疫苗同行评议报告:安全性和有效性都有了!
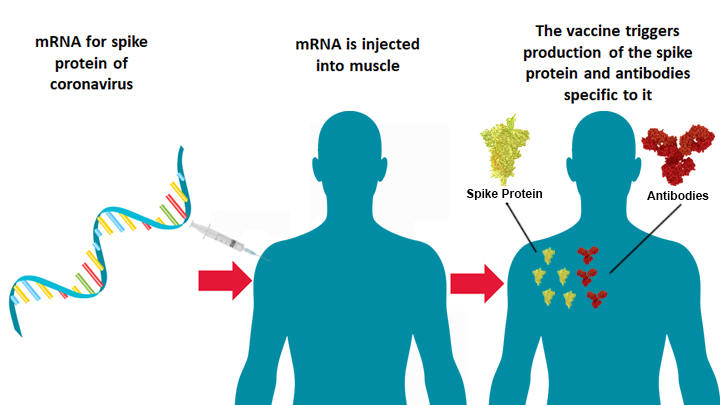
最新出版的国际顶级医学期刊《新英格兰医学杂志》(The New England Journal of Medicine,NEJM)报道的一项3期临床试验的初步结果显示,这款被称为mRNA-1273的调查疫苗在预防症状性(普通型)新冠病毒病 (COVID-19)方面的有效性为94.1%。该疫苗在预防严重COVID-19方面也显示出了效果。调查人员没有发现安全问题,也没有证据表明存在疫苗相关的增强性呼吸道疾病(VAERD)。
该疫苗是由Moderna公司和美国国立卫生研究院(NIH)下属的国家过敏和传染病研究所(NIAID)共同开发的。Moderna, Inc.是一家位于马萨诸塞州剑桥的生物技术公司。Moderna和NIAID此前分享了COVE(新型冠状病毒疫苗有效性)试验的初步结果。2020年12月18日,FDA发布了紧急使用授权,允许Moderna将该疫苗用于预防美国成人COVID-19。
该试验由位于波士顿的哈佛大学布里格姆-妇女医院(Brigham and Women’s Hospital)的首席研究员Lindsey R. Baden医学博士、休斯顿贝勒医学院(Baylor College of Medicine)的医学博士Hana M. El-Sahly以及Meridian临床研究中心(Meridian Clinical Research)的医学博士Brandon Essink领导。该试验是在美国政府的超曲速度行动计划(Operation Warp Speed program)下实施的,并得到了美国卫生与公众服务部负责防范和应对的助理部长办公室领导的生物医学高级研究和开发局(Biomedical Advanced Research and Development Authority ,BARDA)的支持。
该试验于2020年7月27日开始,在美国各地的临床研究中心招募了30420名成年志愿者。志愿者被随机按1:1分配,分别接受两组100微克(mcg)剂量的研究疫苗或两组生理盐水安慰剂,间隔28天。志愿者的平均年龄是51岁。约47%为女性,25%为65岁或以上,17%为65岁以下,医疗条件使他们更有可能患上严重的COVID-19。大约79%的参与者是白人,10%是黑人或非裔美国人,5%是亚裔,0.8%是美国印第安人或阿拉斯加土著,0.2%是夏威夷土著或其他太平洋岛民,2%是混血人,21%(任何种族)是西班牙裔或拉丁裔。
从试验开始到2020年11月25日,调查人员记录了196例有症状的COVID-19病例,这些患者在接受第二次注射后至少14天发生。安慰剂组185例(30例被归类为重度COVID-19),接受mRNA-1273组11例(0例被归类为重度COVID-19)。与接受安慰剂的参与者相比,接受mRNA-1273的参与者COVID-19症状发生率降低了94.1%。
研究人员在参与者首次接种疫苗至少14天后观察到236例有症状的COVID-19病例,其中安慰剂组225例,mRNA-1273组11例。在二次分析中,疫苗有效性为95.2%。
该试验报告的作者表示,接种该mRNA疫苗并不存在安全问题;人体对疫苗的局部反应一般是轻微的。大约50%接受mRNA-1273的参与者在第二次注射后经历了中度到重度的副作用,如疲劳、肌肉疼痛、关节疼痛和头痛,大多数志愿者的症状在两天内就消失了。
调查人员也没有在接受mRNA-1273的患者中发现VAERD的证据。VERD这种罕见的并发症出现在20世纪60年代接种过呼吸道合胞病毒(RSV)全灭活疫苗的个体中,那时还没有能力精确地定义蛋白质结构和测量免疫反应。当疫苗引起的免疫反应不足以防止感染时,就会发生VAERD。
虽然mRNA-1273在预防COVID-19症状方面非常有效,但目前还没有足够的可用数据来得出结论,说明该疫苗是否能影响SARS-CoV-2的传播。初步试验数据表明,单次注射后也可能对无症状感染有一定程度的预防作用。目前正在对无症状感染和感染后病毒脱落的发生率进行进一步分析,以了解疫苗对传染性的影响。
以下为“医牛健康”认证广告内容:
热门文章
版权声明:本平台所有注明“原创”的作品,版权归“医牛”所有,未经书面授权,任何媒体、网站和个人禁止进行转载、摘编、复制等任何使用,未经授权使用将承担相应法律责任。授权转载时须注明“来源; 医牛健康资讯网”。本平台所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。图片均来自于网络,版权属于原作者。
